- NITRIQUE (ACIDE)
- NITRIQUE (ACIDE)L’acide nitrique est industriellement le plus important des dérivés oxygénés de l’azote. Il tient une place de premier plan dans l’industrie des engrais (nitrate d’ammonium en particulier), son rôle demeure considérable dans le domaine des explosifs (poudre noire, T.N.T., mélinite) et ses implications en industrie organique sont multiples (parfums artificiels, industrie de l’aniline, etc.).Préparation industrielle de l’acide nitriqueL’industrie de l’acide nitrique est aujourd’hui couplée de façon pratiquement constante avec celle de l’ammoniac.Les anciens procédés utilisant le nitrate du Chili ont en effet disparu presque totalement en Europe au profit de l’oxydation catalytique de l’ammoniac. Leur importance mondiale ne cesse de décroître. Ils sont fondés sur le déplacment à chaud de l’acide nitrique volatil au moyen de l’acide sulfurique, qui l’est beaucoup moins (système Valentiner).En raison de leur grande solubilité, les nitrates ne se rencontrent pas fréquemment dans la nature. Il existe cependant un important gisement de nitrate de sodium sur les hauts plateaux désertiques et secs de l’Amérique du Sud. Ce nitrate, appelé nitrate du Chili, a été et demeure la matière première de tous les procédés par déplacement.Connu parfois sous le nom de procédé Ostwald, le procédé d’oxydation catalytique de l’ammoniac prend appui sur une observation de Frédéric Kuhlmann faite en 1838. Il comporte trois étapes successives: combustion catalytique de NH3, oxydation à nouveau de l’oxyde azotique NO obtenu, ce qui conduit au peroxyde 2, et enfin absorption de ce dernier par l’eau. Le schéma réactionnel est le suivant:
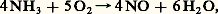 avec H = 漣 900 kJ, et, après oxydation de NO en 2 par l’air:
avec H = 漣 900 kJ, et, après oxydation de NO en 2 par l’air: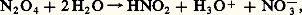 l’acide nitreux, instable, se décompose:
l’acide nitreux, instable, se décompose: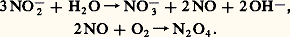 On obtient finalement une solution aqueuse contenant environ 50 p. 100 d’acide nitrique (35 degrés Baumé).Le catalyseur utilisé a été d’abord un alliage platine-rhodium. En raison de son prix élevé, il est progressivement remplacé par un catalyseur, mis au point par la Badische Anilin, à base d’oxyde Fe23 activé par des oxydes de chrome et de bismuth. On l’utilise en couche uniforme de 5 à 6 cm d’épaisseur dans les fours de combustion en brique réfractaire mesurant environ 6 m de diamètre. La réaction commence lorsque la température atteint 250 0C. Comme elle est exothermique, cette température s’élève rapidement. Un équilibre de marche est atteint vers 600-700 0C. Il faut éviter un échauffement excessif susceptible de mener, à 900 0C par exemple, à une combustion de NH3 avec mise en liberté d’azote.En 1987, la production industrielle d’acide nitrique a été en France de l’ordre de 3 600 000 t.L’obtention de l’acide pur est possible à partir des solutions industrielles à 50-60 p. 100. Par distillation de ces solutions, on obtient d’abord à 121,9 0C le mélange azéotropique, qui est à 68,4 p. 100 en H3 (fig. 1). Une nouvelle distillation en présence d’acide sulfurique concentré mène à une solution à 98 p. 100 en acide nitrique. L’acide absolu H3 a été isolé par cristallisation à 漣 42 0C à partir de la solution précédente.Propriétés physiques et structurales de l’acide nitriqueL’acide pur est un liquide incolore bouillant à 84,1 0C et se solidifiant à 漣 41,59 0C.En phase vapeur, l’acide nitrique est monomère. Les molécules individuelles présentent une structure que l’on considère comme plane, bien qu’une rotation du groupement OH autour de la liaison NO contiguë ait été envisagée par certains auteurs. Une barrière de potentiel de 29,3 kJ mol-1 rend cette rotation assez peu vraisemblable et, en tout cas, la met en contradiction avec l’existence de deux angles (O - N - OH) inégaux (1160 et 1140). La figure 2 rend compte des angles et des longueurs de liaison. L’édifice H3 y est rapproché de l’ion nitrate 3-, plan également, mais dont la symétrie parfaite correspond au groupe ponctuel D3h . Ces édifices plans correspondent à l’échange par l’azote de 3 liaisons 靖 impliquant une hybridation sp 2, tandis que les orbitales p z de l’azote et des trois atomes d’oxygène mènent à des interactions de type 神.L’acide nitrique pur obtenu à l’état liquide par fusion des cristaux ne correspond pas à la présence de molécules individuelles H3. La molécule d’acide nitrique, aussi bien que celle de l’eau, est un accepteur et un donneur de proton. Une ionisation intervient selon la réaction 1, le cation se dissociant ensuite selon la réaction 2. À 漣 40 0C, le pourcentage de dissociation atteint déjà 3,5 p. 100 des molécules H3. La dilution de l’acide pur dans de l’eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s’identifie à l’équilibre classique d’un acide en solution dans l’eau (réaction 4).Le tableau illustre bien l’évolution des espèces présentes en fonction de la dilution.Propriétés chimiques de l’acide nitriqueLes propriétés chimiques peuvent se classer en trois groupes: HNO3 est un acide fort, c’est un oxydant et un agent de nitration.Les propriétés acides se trouvent directement illustrées par l’équilibre de dissociation en milieu dilué (réaction 4). Toutefois, si de l’acide pur est ajouté à un autre acide, il se comportera comme un donneur protonique si ce second acide est le plus faible, mais pourra au contraire jouer le rôle d’accepteur protonique dans l’hypothèse inverse (réaction 5).Les propriétés oxydantes peuvent être illustrées par l’action de l’acide nitrique sur les métaux. Tous ne réagissent pas: le comportement possible peut être dégagé des deux schémas suivants (réactions 6).Tout métal dont le potentiel normal d’oxydoréduction est supérieur à 0,96 V ne peut être oxydé. Il en est ainsi de l’or (Eo = 1,38 V) et du platine (Eo = 1,60 V).Tout métal dont le potentiel d’oxydo-réduction est compris entre 0,80 et 0,96 V est oxydé, le gaz dégagé contient de l’oxyde azotique NO, incolore; c’est le cas du mercure (Eo = 0,86 V).Tout métal, enfin, dont le potentiel d’oxydoréduction est inférieur à 0,80 V est oxydé selon les deux réactions simultanément possibles, et avec dégagement d’un mélange NO 漣 2 (vapeurs nitreuses) de composition variable selon le métal et la concentration de l’acide.Les réactions de nitration mettent en jeu l’ion 2+ résultant du processus d’ionisation H3 en milieu acide fort. L’exemple le plus classique concerne l’obtention de nitrobenzène par action d’un mélange sulfonitrique sur le benzène selon le processus:
On obtient finalement une solution aqueuse contenant environ 50 p. 100 d’acide nitrique (35 degrés Baumé).Le catalyseur utilisé a été d’abord un alliage platine-rhodium. En raison de son prix élevé, il est progressivement remplacé par un catalyseur, mis au point par la Badische Anilin, à base d’oxyde Fe23 activé par des oxydes de chrome et de bismuth. On l’utilise en couche uniforme de 5 à 6 cm d’épaisseur dans les fours de combustion en brique réfractaire mesurant environ 6 m de diamètre. La réaction commence lorsque la température atteint 250 0C. Comme elle est exothermique, cette température s’élève rapidement. Un équilibre de marche est atteint vers 600-700 0C. Il faut éviter un échauffement excessif susceptible de mener, à 900 0C par exemple, à une combustion de NH3 avec mise en liberté d’azote.En 1987, la production industrielle d’acide nitrique a été en France de l’ordre de 3 600 000 t.L’obtention de l’acide pur est possible à partir des solutions industrielles à 50-60 p. 100. Par distillation de ces solutions, on obtient d’abord à 121,9 0C le mélange azéotropique, qui est à 68,4 p. 100 en H3 (fig. 1). Une nouvelle distillation en présence d’acide sulfurique concentré mène à une solution à 98 p. 100 en acide nitrique. L’acide absolu H3 a été isolé par cristallisation à 漣 42 0C à partir de la solution précédente.Propriétés physiques et structurales de l’acide nitriqueL’acide pur est un liquide incolore bouillant à 84,1 0C et se solidifiant à 漣 41,59 0C.En phase vapeur, l’acide nitrique est monomère. Les molécules individuelles présentent une structure que l’on considère comme plane, bien qu’une rotation du groupement OH autour de la liaison NO contiguë ait été envisagée par certains auteurs. Une barrière de potentiel de 29,3 kJ mol-1 rend cette rotation assez peu vraisemblable et, en tout cas, la met en contradiction avec l’existence de deux angles (O - N - OH) inégaux (1160 et 1140). La figure 2 rend compte des angles et des longueurs de liaison. L’édifice H3 y est rapproché de l’ion nitrate 3-, plan également, mais dont la symétrie parfaite correspond au groupe ponctuel D3h . Ces édifices plans correspondent à l’échange par l’azote de 3 liaisons 靖 impliquant une hybridation sp 2, tandis que les orbitales p z de l’azote et des trois atomes d’oxygène mènent à des interactions de type 神.L’acide nitrique pur obtenu à l’état liquide par fusion des cristaux ne correspond pas à la présence de molécules individuelles H3. La molécule d’acide nitrique, aussi bien que celle de l’eau, est un accepteur et un donneur de proton. Une ionisation intervient selon la réaction 1, le cation se dissociant ensuite selon la réaction 2. À 漣 40 0C, le pourcentage de dissociation atteint déjà 3,5 p. 100 des molécules H3. La dilution de l’acide pur dans de l’eau limite cet effet, déplace le dernier équilibre vers la gauche et provoque la réaction 3, de sorte que le bilan global s’identifie à l’équilibre classique d’un acide en solution dans l’eau (réaction 4).Le tableau illustre bien l’évolution des espèces présentes en fonction de la dilution.Propriétés chimiques de l’acide nitriqueLes propriétés chimiques peuvent se classer en trois groupes: HNO3 est un acide fort, c’est un oxydant et un agent de nitration.Les propriétés acides se trouvent directement illustrées par l’équilibre de dissociation en milieu dilué (réaction 4). Toutefois, si de l’acide pur est ajouté à un autre acide, il se comportera comme un donneur protonique si ce second acide est le plus faible, mais pourra au contraire jouer le rôle d’accepteur protonique dans l’hypothèse inverse (réaction 5).Les propriétés oxydantes peuvent être illustrées par l’action de l’acide nitrique sur les métaux. Tous ne réagissent pas: le comportement possible peut être dégagé des deux schémas suivants (réactions 6).Tout métal dont le potentiel normal d’oxydoréduction est supérieur à 0,96 V ne peut être oxydé. Il en est ainsi de l’or (Eo = 1,38 V) et du platine (Eo = 1,60 V).Tout métal dont le potentiel d’oxydo-réduction est compris entre 0,80 et 0,96 V est oxydé, le gaz dégagé contient de l’oxyde azotique NO, incolore; c’est le cas du mercure (Eo = 0,86 V).Tout métal, enfin, dont le potentiel d’oxydoréduction est inférieur à 0,80 V est oxydé selon les deux réactions simultanément possibles, et avec dégagement d’un mélange NO 漣 2 (vapeurs nitreuses) de composition variable selon le métal et la concentration de l’acide.Les réactions de nitration mettent en jeu l’ion 2+ résultant du processus d’ionisation H3 en milieu acide fort. L’exemple le plus classique concerne l’obtention de nitrobenzène par action d’un mélange sulfonitrique sur le benzène selon le processus: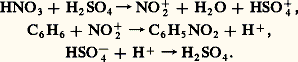 Cette réaction, fortement exothermique, doit être contrôlée par refroidissement à 0 0C du système réactionnel.Les dérivés nitrés sont très importants, citons:C6H52, nitrobenzène, parfum artificiel, qui sert à fabriquer l’aniline;Les nitratesLes nitrates sont les sels de l’acide nitrique. Tous sont très solubles dans l’eau. Les édifices obtenus avec les éléments les plus électropositifs sont nettement ioniques, mais les dérivés correspondant aux métaux les moins électropositifs sont vraisemblablement des nitratocomplexes. Le groupement 3- peut alors fonctionner comme coordinat monodentate ou bidentate. Les processus de décomposition thermique traduisent d’ailleurs les modes de liaisons différents: alors que les nitrates ioniques mènent aux nitrites, les nitratocomplexes conduisent directement aux oxydes métalliques.Tous les nitrates tendent à se comporter comme des agents oxydants, mais, dans le cas d’un élément métallique susceptible de présenter deux degrés d’oxydation possibles, les nitrates correspondant au degré le plus élevé réagissent de façon très vive. Ainsi Sn(NO3)4 provoque l’inflammation de l’éther ou de l’aniline. Zn(NO3)2, au contraire, est pratiquement inerte.L’importance industrielle des nitrates reste considérable. Intimement associés au soufre et au charbon, les nitrates alcalins constituent la poudre noire qui fut longtemps le seul explosif connu. La vivacité, la force et le potentiel des poudres noires varient beaucoup avec leur composition. Le nitrate de sodium (nitrate du Chili) et surtout le nitrate d’ammonium, obtenu par synthèse, sont des engrais très utilisés. Ce sont des fertilisants à action lente et prolongée. L’hygroscopicité des nitrates est toutefois un inconvénient pour leur conditionnement et leur stockage. Il est ainsi d’une pratique courante d’ajouter au nitrate destiné aux engrais une ou des substances destinées à pallier sa prise en mottes à cause de son hygroscopicité. L’emploi de matières organiques à cet effet (emballages de papier ou de bois) est susceptible d’induire une explosion. L’emploi de 0,75 p. 100 de mazout en plus de 3,5 p. 100 d’argile, pratiqué couramment aux États-Unis, est vraisemblablement responsable des explosions de Texas City et de Brest en 1947.
Cette réaction, fortement exothermique, doit être contrôlée par refroidissement à 0 0C du système réactionnel.Les dérivés nitrés sont très importants, citons:C6H52, nitrobenzène, parfum artificiel, qui sert à fabriquer l’aniline;Les nitratesLes nitrates sont les sels de l’acide nitrique. Tous sont très solubles dans l’eau. Les édifices obtenus avec les éléments les plus électropositifs sont nettement ioniques, mais les dérivés correspondant aux métaux les moins électropositifs sont vraisemblablement des nitratocomplexes. Le groupement 3- peut alors fonctionner comme coordinat monodentate ou bidentate. Les processus de décomposition thermique traduisent d’ailleurs les modes de liaisons différents: alors que les nitrates ioniques mènent aux nitrites, les nitratocomplexes conduisent directement aux oxydes métalliques.Tous les nitrates tendent à se comporter comme des agents oxydants, mais, dans le cas d’un élément métallique susceptible de présenter deux degrés d’oxydation possibles, les nitrates correspondant au degré le plus élevé réagissent de façon très vive. Ainsi Sn(NO3)4 provoque l’inflammation de l’éther ou de l’aniline. Zn(NO3)2, au contraire, est pratiquement inerte.L’importance industrielle des nitrates reste considérable. Intimement associés au soufre et au charbon, les nitrates alcalins constituent la poudre noire qui fut longtemps le seul explosif connu. La vivacité, la force et le potentiel des poudres noires varient beaucoup avec leur composition. Le nitrate de sodium (nitrate du Chili) et surtout le nitrate d’ammonium, obtenu par synthèse, sont des engrais très utilisés. Ce sont des fertilisants à action lente et prolongée. L’hygroscopicité des nitrates est toutefois un inconvénient pour leur conditionnement et leur stockage. Il est ainsi d’une pratique courante d’ajouter au nitrate destiné aux engrais une ou des substances destinées à pallier sa prise en mottes à cause de son hygroscopicité. L’emploi de matières organiques à cet effet (emballages de papier ou de bois) est susceptible d’induire une explosion. L’emploi de 0,75 p. 100 de mazout en plus de 3,5 p. 100 d’argile, pratiqué couramment aux États-Unis, est vraisemblablement responsable des explosions de Texas City et de Brest en 1947.
Encyclopédie Universelle. 2012.
